경제
K-제약·바이오, 폐 굳는 난치병 정복…치료제 개발 ‘두각’
- 0
- 가
- 가
대웅제약, 베프시포로신 임상 2상 내년 완료할 계획
브릿지바이오, BBT-877 임상 2상 내년 초 발표 준비
넥스트젠, NXC680 임상 1상 시험 계획 식약처 승인

[마이데일리 = 박성규 기자] 국내 제약·바이오 기업이 폐 조직이 딱딱하게 굳는 희귀질환 ‘특발성 폐섬유증(IPF)’ 치료제 개발에 두각을 보이고 있다.
22일 제약·바이오업계에 따르면 대웅제약·브릿지바이오테라퓨틱스·넥스트젠바이오사이언스 등 기업이 특발성 폐섬유증(IPF) 임상 1·2상을 진행하며 치료제 개발에 속도를 내고 있다.
IPF는 알 수 없는 원인으로 폐가 서서히 굳어가는 폐질환이다. 난치병으로 치료제는 존재하지만, 병 진행 속도를 늦추는 수준이다.
글로벌에서 선두는 독일 제약사 베링거인겔하임이 임상 3상을 진행 중이다. 국내에서 대웅제약, 브릿지바이오테라퓨틱스, 넥스트젠바이오사이언스 등이 그 뒤를 바짝 쫓고 있다.
글로벌 시장조사기관 리서치앤드마켓에 따르면 특발성 폐섬유증 치료제 시장은 올해 46억달러(6조3000억원)에서 2030년에는 70억달러(9조6000억원) 규모로 성장할 전망이다.
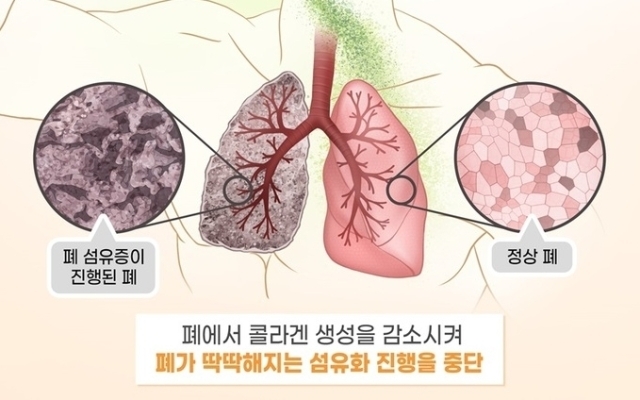
대웅제약은 IPF 치료제 ‘베르시포로신’ 임상 2상을 이어가고 있다. 베르시포로신은 IPF 원인이 되는 콜라겐 생성에 영향을 주는 단백질 작용을 감소시킨다.
지난 7월 베르시포로신은 2차 독립적 데이터 모니터링 위원회(IDMC) 회의에서 임상 지속을 권고받았다. IDMC는 내년 초 예정된 3차 회의에서 베르시포로신 임상 2상 안전성을 최종 점검할 예정이다. 임상 2상은 2025년 내로 완료할 계획이다.
대웅제약 관계자는 “이번 IDMC 권고는 베르시포로신 원활한 개발에 있어 안전성을 입증한 중요한 이정표”라며 “베르시포로신 개발로 IPF 환자에게 새로운 치료 옵션을 제공할 수 있도록 최선을 다하겠다”고 밝혔다.
브릿지바이오테라퓨틱스는 IPF 치료제 후보물질 ‘BBT-877’ 글로벌 임상 2상을 진행 중이다. 이 약은 신규 표적 단백질인 오토택신을 선택적으로 저해하는 물질이다. 브릿지바이오는 이달 제4차 IDMC로부터 2상 임상시험을 지속하도록 권고받았다.
현재 임상시험 대상자 129명 중 82명이 24주 투약 절차를 모두 마무리했다. 내년 4월 톱라인 데이터 발표 준비와 글로벌 기술이전 계약 협상을 통한 사업화에 매진할 계획이다.
브릿지바이오테라퓨틱스 관계자는 “글로벌 임상 연구자·환자, 유관 기관 적극적인 협력을 토대로 남은 시험 절차를 순조롭게 마무리할 계획이다”며 “경쟁력 있는 데이터 발표로 조속한 사업화 성과로 보답하겠다”고 자신했다.
넥스트젠바이오사이언스는 지난 7월 식품의약품안전처로부터 IPF 치료제로 개발 중인 오토택신 저해제 ‘NXC680’ 임상 1상 시험 계획을 승인받았다.
NXC680은 오토택신 작용을 억제함으로써 리소포스파티드산 생성을 줄여 항염증·항섬유화 효과를 나타낸다. 폐 섬유화 원인인 콜라겐 과도한 생성을 억제하고, 염증 반응을 차단하는 저분자 합성신약이다.
넥스트젠 관계자는 “동물모델에서 우수한 폐섬유증 치료 효과, 폐 기능 개선 효과·안전성이 확인됐다”며 “비임상시험 약력학 시험결과를 토대로 시뮬레이션해 볼 때 임상에서 경쟁약물 대비 저용량에서도 우수한 억제효능을 나타낼 것으로 기대한다”고 말했다.
박성규 기자 psk@mydaily.co.kr
- ⓒ마이데일리(www.mydaily.co.kr).
무단전재&재배포 금지 -



















댓글
[ 300자 이내 / 현재: 0자 ]
현재 총 0개의 댓글이 있습니다.